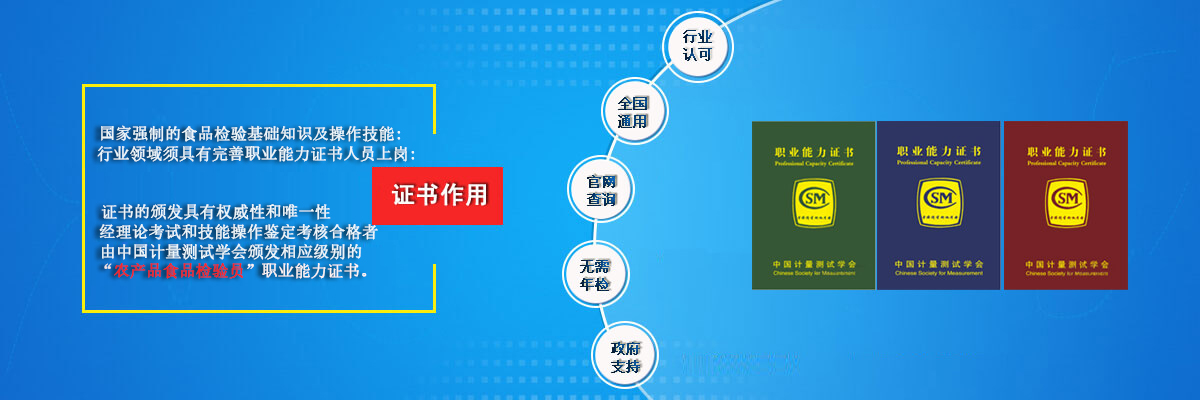
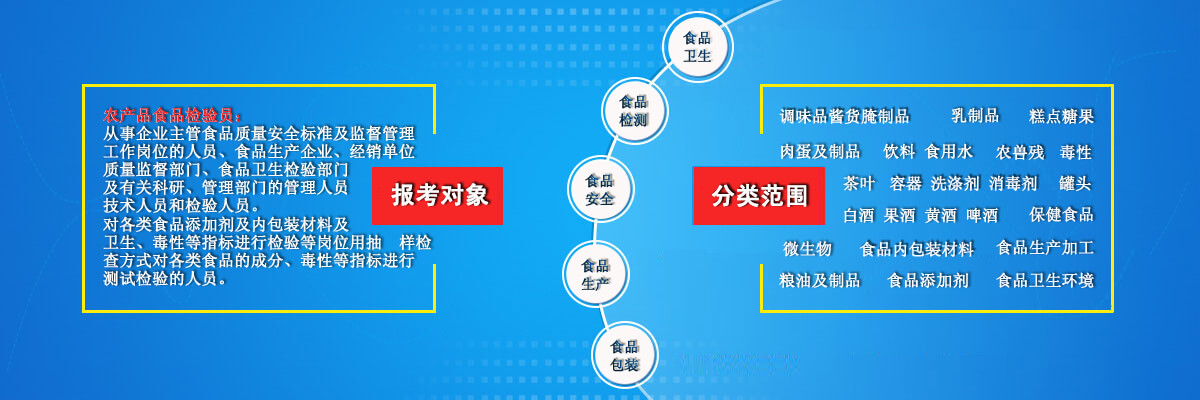
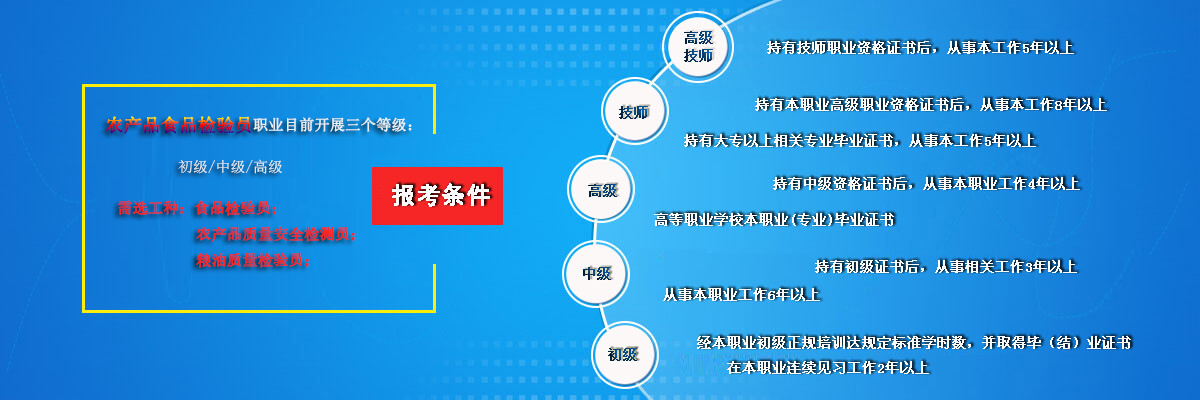
食品理化检测实验技巧干货分享
1、薄层色谱鉴别时,可以将展开剂放在双槽层析缸的一边,然后把点好的板子放在双槽的另一边饱和半小时候,然后再放在展开剂的一边展开,这样跑出来的点比较圆。
2、在一般的过滤溶液时,如果不好过滤,建议将溶液离心后用上清液过滤,也可以用抽滤,这样不会影响测定结果,也不浪费时间。
3、做快速水分法时,连续测定样品,须等温度降下来后再加样,否则在加样过程中受热水分蒸发造成结果偏低。
4、HPLC中流动相中加了三乙胺可以减小拖尾,关键是pH值。
5、用液相测含量时,因每次配制的流动相有差异,按标准配制的流动相,有时峰分不开,可以适当调整比例,改善效果。
6、抗生素的效价测定时加菌量一定要准确 否则结果会相差很大 不建议使用10mL的刻度吸管无菌实验时,HTY601集菌仪使用之前先观察集菌培养器的软管走势是否顺畅,这时不宜使用太小的转数,因为很容易挤断软管,大约在70转数即可。
7、0.05M磷酸氢二钠250mL与250mL乙腈互溶后有白色絮状沉淀,后超声逐渐溶解变澄清。
8、做氢氧化钠的氯化物检查时,先要将其用稀硝酸调节PH,否则结果很不准确!
9、在使用全自动电子天平时,尤其是十万分之一的天平,很容易发生读数飘移。在称量过程中,注意关好门窗,确保称量环境的安静,在天平的不需加样的一侧用一本厚重的文件夹挡住,会有利于维护环境的稳定。
10、做马来酸氯苯那敏的有关物质的时候,采用气相法,样品的溶剂峰旁边会出来一个大峰,此峰在对照品中并无出现,容易疑惑是杂质并判断为超标,实际此峰是马来酸的峰,即马来酸氯苯那敏进样后会分解成马来酸与氯苯那敏两个峰。在做判断时不止应扣除溶剂峰,还应扣除马来酸峰。这样才是真正结果。
11、若离心的方法损失有效成分较多,则可以选择冷置一夜,可以节省能源呵。
12、绿原酸对照品的溶液很不稳定,最好现配现用。
13、在做液相时候,如果保留时间不一致,看看室内温度变化情况,还有就是你要是手动进样时,进样速度也有关系!
14、检测硫酸阿米卡星的硫酸盐,要求在紫色开始消失的时候加50mL乙醇,可是开始消失的点不好判断,一般是在加了5mL多EDTA滴定液之后就加乙醇,滴定结果一般消耗7-8mL,加的太晚有时候很难出终点。
15、点样之前先将薄层板活化一下,能够使结果更加优化,我通常放在烘箱里烤5分钟,再取出放冷。另外,展开剂应尽量精确,尤其是比例比较接近的是放在110℃烘箱烘30min,我觉得不应该等到放冷,立马就可以点样,原因:
(1)刚活化的板温度高,散热快;
(2)放冷的过程种很容易吸潮。
16、用HPLC法测物质有关物质时,样品放置的时间以及放置的温度极其重要,所以最好现用现配,或者配好的样品液一定要低温保存,条件允许的话可以加一个自动上样控温装置,这样可防止杂质的降解,保证结果准确度。
17、做薄层展开的时候,特别是中药的品种,一定要注意温度的变化!比如人参就得再10度一下才能分开。再就是预饱和,这个环节也很重要!
18、有些溶剂在分层中很容易乳化,建议大家不要用力摇晃,如果是鉴别就颠倒着轻轻晃就可以了,如果已经乳化了建议用热风吹效果好。如果是含量测定乳化后建议冷冻效果要比热风吹好。如非必要不要加多余的东西,结果会有影响。
19、做HPLC时大多数都可以在泵头和管路连接处发现有白色的结晶出现。产生这种结晶的原因是使用了含缓冲盐的流动相后,对系统冲洗时间不够,管路中残留了少量的缓冲盐随流动相渗出造成的。如果有朋友发现相同的问题,只要延长冲洗时间就可以解决。
20、在做薄层时层析缸的气密性也很重要,新的层析缸最好在缸口涂点凡士林。做滴定时一定要注意所配溶液是否和以前的溶液的性状相同(如:颜色),如果不同就要考虑试剂、溶剂和器皿是不是变质或被污染了。
21、做紫外时因重视仪器的预热时间,预热时间太短,对实验结果的影响很大。
22、我看到有很多实验员在配置薄层板的CMC-Na溶液时喜欢加热,使其快速完全的溶解。这样做有一个很大的弊端,制作出来的薄层板是非常不平滑的,建议还是让其自己慢慢溶解,即时不能完全溶解,也可以使用。
23、我们在做不同厂家同一原料药的熔点时发现该原料药的熔点均不符合规定,在查找原因时,我们发现是介质硅油的原因。因为在测定熔点前看到介质硅油很脏了,里面有很多黑色浮游物,我们用棉花对其进行了过滤,硅油是清了,但测出的熔点数据错了。换了新的硅油,熔点正常。
24、在进行氯化物检测时,如果使用滤纸过滤,一定要先用稀硝酸处理后在过滤样品,否则会对结果产生很大影响。
25、仪器分析中所用的试剂质量很关键,我们做抗生素的聚合物含量时,经常在聚合物出峰的时间也出现倒峰,查找了所有仪器和溶剂,最后确定是一个化学试剂厂生产的磷酸二氢钠的原因。
26、用安捷伦1100高效液相时,如果标准是用100%甲醇溶解的话,一定要稀释,一般用50%的甲醇,否则就拖尾。记住啊,100%的准确啊。
27、新霉素鉴别项颜色反应称样量要用万分之一天平,否则做不出来。
28、用液相色谱法测含量时,跑基线的时间一定要足够长,有时基线虽在短时间内平了,但色谱柱还没有充分饱和,导致在用了柱温箱的情况下,出峰的保留时间也会有很大差异!
29、进行HPLC检测使用磷酸盐缓冲液:乙腈做缓冲液时时,当缓冲液比例小于50%时,由于混合过程是吸热反应,在该过程中磷酸盐会析出晶体,造成流动相混浊而报废。如强行使用会阻塞色谱管道,对于这种情况,可以有以下两种处理方法,一时首先配制50:50的溶剂,然后10%加入,超声至高于室温,在加入10%,再超声高于室温,直至到达所需比例。另一种是首先配制不带盐的流动相,再超声至高于室温后,加入固体盐,超声至溶解,再过滤。
30、在清洗容量瓶和移液管时,最好用洗液清洗常用的是重铬酸钾和硫酸配比的洗液;在洗涤剂清洗不干净时,可用一些回收的乙醇进行超声。
31、在做试验之前,一定要检查盛装样品的小瓶或蒸发皿等容器没有裂纹及完好无损,本人有好几次深受其害。
32、做液相时如果流动相有缓冲盐,一定要注意你的色谱柱的冲洗。不然峰的分离度不好。
33、以前取清膏都是用灭菌后的锥形瓶,现在直接有用移液管抽取10mL到配制灭菌好的缓冲液中,菌检结果还很好,免得清膏黏糊黏糊的难得清洗。
34、做HPLC的时候,要是流动相中含有盐晶离子,那冲柱子的时候一定要有水先冲一次(水:蒸馏水超升的),再用30%的甲醇冲洗,最后用甲醇冲洗。
35、在测比重的时候,温度对结果的影响很大,以前不是很注意,现在基本上都放在20摄氏度的水浴锅中一段时间再测。
36、做紫外的过程中,要注意石英比色皿,如果不干净的话,也千万不能用超声来清洗,可以用甲醇和稀硝酸的混合液来浸泡,并且用时要认准石英比色皿两个光滑面(保证光从有S的一个光洁面入射)。
37、做HPLC的时候,走空白时,发现不停的有杂质峰出现,用流动相无法冲洗干净,可能是进样器,可能是泵,可能是柱子被污染了,可以用色谱级的异丙醇冲洗系统24h以上。
38、我本人现在虽然不做分析员了,但从事了4年的检验工作,在此与大家分享一下我的个人经验吧。检测结果的准确性于很多因素有关:
(1)检测环境包括湿度、温度,特别是仪器分析。所以仪器分析室要有中央空调,HLPC最好配置温控;
(2)样品称量。天平是否在适宜的温度、湿度,称量范围是否校验过;称量过程是否规范;对于吸湿性样品称样速度要快;
(3)样品的处理:所用溶剂要按规定的配置且在有效期内、移液管洁静、使用规范。当然,样品处理是很重要的,液需要经验值.不同产品性质不同,处理也不一样.。
39、我觉得,在做抑菌实验时,最好不要图方便,老是先把小滤纸片贴到培养基上,再用精密移液器量取几微升试样滴于滤纸片上。因为要是移取试液的量很少很少时还勉强可以,如果稍大时,由于小滤纸片吸收液体的量很容易达到饱和,那么余下的试液就会往纸片四周冲散开来,那就导致了抑菌圈变大,结果也就失去可信性了。最好是把纸片浸于试液中,取出晾干后再贴在培养基上。