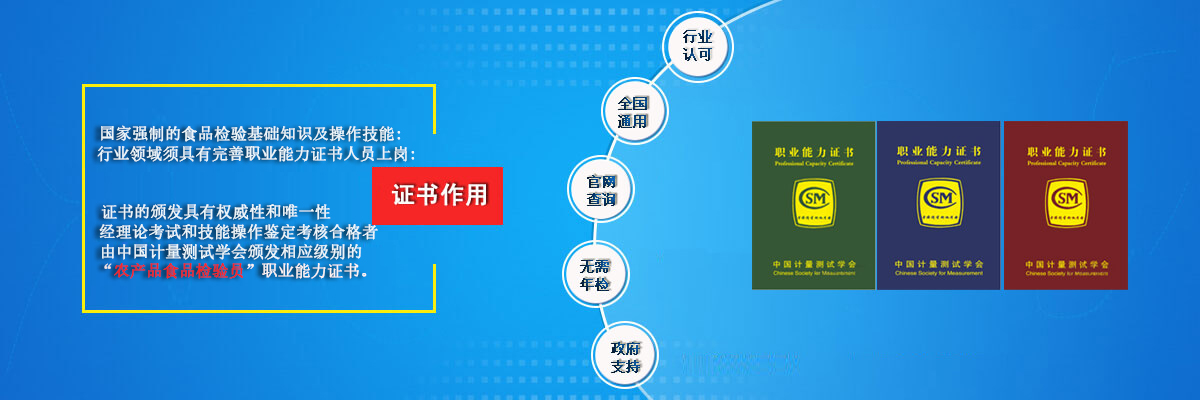
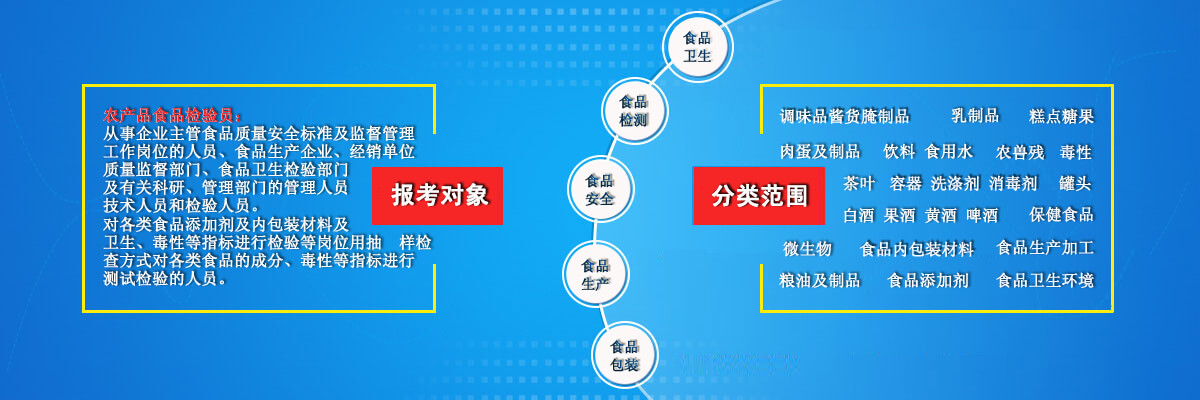
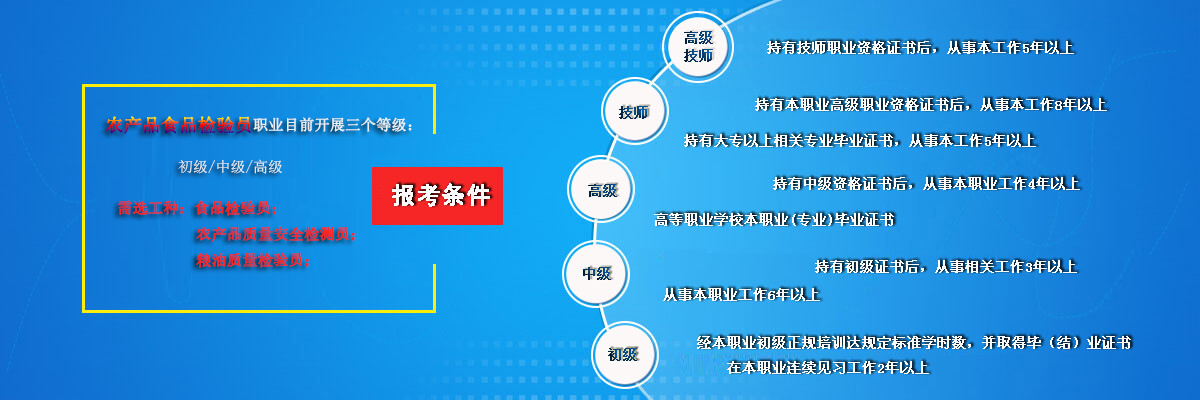
食品微生物检测操作常见问题及解决办法
在全民关注食品安全的当下,食品微生物检测作为食品安全检测不可或缺的一环,也成为食品安全检测的重中之重。
通过食品微生物检验,可以判断食品加工环境及食品卫生情况,能够对食品被细菌污染的程度作出正确的评价,那么在食品微生物检测中,大家经常会遇到哪些问题?又该如何解决?
| 01.菌落总数的测定,只做一个稀释度行吗?
| 02.同一个稀释度,菌落总数一个在计数范围,一个不在计数范围,怎么计?
| 03.涂抹样品的检测,应当怎样计数和报告?
| 04.培养基配置有哪些注意事项?
| 05.剩余的培养基再次使用是否重新灭菌?
| 06.霉菌计数如何保证结果准确?
| 07.无菌水、生理盐水、磷酸盐缓冲液三者有什么区别?
| 08.培养皿接种后为什么要倒置?
菌落总数的测定,只做一个稀释度行吗?
不可行。在GB 4789.2中要求每个样品选择2-3个适宜的稀释度进行检测。即使一个样品已经基本可以确定了菌落数了,也建议多检测一个稀释度,多一个稀释度也会对检测结果进行验证,只测一个稀释度会存在风险。
另外如果严格按照国标要求,这样的检测也是不符合要求的,某些要求严格的外审部门可能会对此开具不符合项。因此在检测中还是应该严格按照国家标准执行。
02
同一个稀释度,菌落总数一个在计数范围,一个不在计数范围,怎么计?
同一稀释度的两个平板,一个在计数范围内,一个不在计数范围内,则以在计数范围内的平板的菌落数乘以稀释倍数作为报告结果。
举例来说明,某样品检测结果:10-1两平板菌落数分别为320、288,10-2稀释度两平板菌落数为27、23,则样品的检测结果应选取288进行报告,报告结果为2.9*103CFU/g。
03
涂抹样品的检测,应当怎样计数和报告?
涂抹样品检测的计数是比较复杂的,给大家举例子来说明!
假如你涂抹的样品面积是25cm²,采样的涂抹液是10mL,而检测只吸取1mL样液,即检测的是原样品的10-1的稀释度,即平板计数菌落*10为样品中的菌落数。结果报告就是菌落数/取样面积。例如,取样面积是25cm²,检测平皿上计数为13,则结果报告应该为13*10CFU/25cm²。
04
培养基配置有哪些注意事项?
(1) 灭菌温度要严格控制,按照要求灭菌,尤其含糖量较高的培养基温度不应太高,过高会导致糖分焦化,影响质量;
(2) 琼脂培养基不能反复溶化。反复溶化会破坏培养基中的营养成分;
(3) 培养基不能反复灭菌,反复灭菌也会导致营养成分的破坏;
(4) 含琼脂的培养基灭菌后,要摇匀。
05
剩余的培养基再次使用是否重新灭菌?
这分为两种情况。第一种情况,已经凝固后重新融化后使用的,根据GB 4789.28-2013中明确规定,未用完的培养基不可重新凝固留待下次使用。遇到这种情况,培养基只能弃置,并且国标要求,弃置也需要符合相关法律法规的规定。
第二种情况,首次灭菌后未用完的培养基,可待培养基凝固后再进行保存。但保存条件需避光干燥,保证其成分不会发生改变。再次使用时按照要求进行融化即可,不可二次灭菌。首次灭菌已开封但未使用完的培养基,不建议再次使用,毕竟存在风险。但若是液体培养基,就不存在融化的过程,首次灭菌后未使用完毕可按照国标要求保存,使用时需要保证培养基成分不发生改变,不可进行二次灭菌。若无法保证培养基是否符合要求,应当弃置。
06
霉菌计数如何保证结果准确?
霉菌菌落由孢子和菌丝组成,相当扩散,在直径9cm的平皿里,菌落数稍多就相互交叉重叠,影响计数,但数量太少又会产生较大的误差,因此选择适当的稀释度计数是保证结果准确的关键环节之一。
我们对这方面作了一些观察研究,首先是将实验菌株的斜面培养物制成含有约106个/ml的孢子悬液,并用血球计数器在显微镜下准确计数,然后将孢子悬液作10-1~10-6倍稀释,吸取不同稀释度的稀释液接种于PDA,25℃培养5天后计数。30种常见霉菌的两种不同计数方法所得结果比较显示,大部分菌株每平板含有10~50个菌落的稀释度时的计数与显微镜计数结果最接近;有近一半的菌株,每个平板含50~100个菌落已较难计数,而大部分菌株,超过100个/平皿或小于10个/平皿的计数结果就与显微计数结果存在较大差别,因此,应尽量选择10~50个/平皿的稀释度进行霉菌计数。
而对上述提及的菌丝很丰富、菌落特别扩散的毛霉、根霉、犁头霉等菌株,则应在更少的范围内计数(30个/平皿以内)。为控制霉菌的生长速度和菌落的生长范围,可在培养基中添加少量抗生素,如氯霉素(50~100mg/L),金霉素(20~100mg/L),庆大霉(50mg/L),土霉素(100mg/L)等。
07
无菌水、生理盐水、磷酸盐缓冲液三者有什么区别?
无菌水就是简单的检测水进行灭菌;生理盐水是0.85%的NaCl水溶液;磷酸盐缓冲液一般是选择磷酸二氢钠和磷酸氢二钠按照一定比例配制的缓冲液。
在食品微生物检测中,三者最主要的区别在于对菌的保护作用。无菌水不存在对菌的保护,因为渗透压的作用,还可能造成菌吸水胀裂死亡;生理盐水的渗透压基本与菌的细胞液相当,会对菌有一定的保护。磷酸盐缓冲液除了在渗透压方面对菌有保护作用,对pH也有一定的缓冲作用,因此对菌有更好的保护。国标要求,微生物检测需要用生理盐水或磷酸盐缓冲液稀释。但也有部分研究表明,检测样品若NaCl含量超过10%也可以使用无菌水稀释,但并未被国家标准认可。
培养皿接种后为什么要倒置?
接种后,将平板倒置,既可防止冷凝水滴到培养基上,避免杂菌污染;又利于菌种的生长、繁殖和计数。
1.利于菌种的生长和繁殖
培养条件为必须通风时,倒置的平板可以减少培养基表面的空气流动,减慢培养基中水分蒸发的速度,保持琼脂等固体培养基中的水分,充分的维持琼脂等凝固剂的弹性,延长培养基出现干裂的时间。所以,倒置培养有利于菌种的繁殖和生存。如果将平板正放,大概几天时间培养基就会出现水分散失和开裂的情况。可见,防止培养过程中水分散失是非常重要的。
2.防止培养过程中杂菌污染平板
倒置培养时,由于平板内的空气不易流动,能尽可能的减少外来杂菌的侵染,避免杂菌污染培养基和培养物。通过实验观察,发现如果平板正放,平板的周边容易长出杂菌菌落。
3.有利于营养物质富集,方便观察计数
平板倒置进行微生物培养时,受重力的影响,一方面培养基中的营养物质主要会富集在培养基表面及表面以下的次层,有利于微生物生长;另一方面培养基表面生长的菌落相对不会太快扩散,观察时有利于辨别菌落特征。
其它
(1)由于现在一般拿平板的操作均为:小盖子朝向手心,五指张开抓住平板,大拇指推动平板的大盖子进行操作,所以倒置平板有利于操作;
(2)其他人打开培养箱的时候一不小心就把平皿盖给打开了,倒置培养的时候不容易打开。