食品中大肠菌群的检测方法
1 范围
本标准规定了食品中大肠菌群(Coliforms)计数的方法。
本标准适用于食品中大肠菌群的计数。
2 术语和定义
2.1 大肠菌群coliforms
在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽胞杆菌。
2.2 最可能数most probable number,MPN 基于泊松分布的一种间接计数方法。
3 设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
3.1 恒温培养箱:36 ℃±1 ℃。
3.2 冰箱:2 ℃~5 ℃。
3.3 恒温水浴箱:46 ℃±1 ℃。
3.4 天平:感量 0.1 g。
3.5 均质器。
3.6 振荡器。
3.7 无菌吸管:1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)或微量移液器及吸头。
3.8 无菌锥形瓶:容量 500 mL。
3.9 无菌培养皿:直径 90 mm。
3.10 pH计或 pH比色管或精密 pH试纸。
3.11 菌落计数器。
4 培养基和试剂
4.1 月桂基硫酸盐胰蛋白胨(Lauryl Sulfate Tryptose,LST)肉汤
4.2 煌绿乳糖胆盐(Brilliant Green Lactose Bile,BGLB)肉汤
4.3 结晶紫中性红胆盐琼脂(Violet Red Bile Agar,VRBA)
4.4 磷酸盐缓冲液
4.5 无菌生理盐水
4.6 无菌 1 mol/L NaOH
4.7 无菌 1 mol/L HCl
大肠菌群MPN计数法
5 检验程序
大肠菌群MPN计数的检验程序见图1。
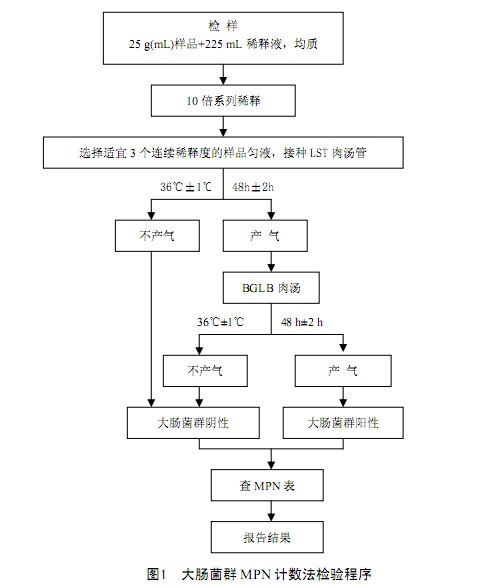
6 操作步骤
6.1 样品的稀释
6.1.1 固体和半固体样品: 称取 25 g 样品,放入盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌均质杯内, 8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打 1 min~2 min,制成 1:10 的样品匀液。
6.1.2 液体样品:以无菌吸管吸取 25 mL 样品置盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成 1:10 的样品匀液。
6.1.3 样品匀液的 pH值应在 6.5~7.5 之间,必要时分别用 1 mol/L NaOH或 1 mol/L HCl 调节。
6.1.4 用 1 mL 无菌吸管或微量移液器吸取 1:10 样品匀液1 mL,沿管壁缓缓注入 9 mL 磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用 1 支1 mL 无菌吸管反复吹打,使其混合均匀,制成 1:100 的样品匀液。
6.1.5 根据对样品污染状况的估计,按上述操作,依次制成十倍递增系列稀释样品匀液。每递增稀释1 次,换用1支 1 mL 无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过 15 min。
6.2 初发酵试验
每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1mL(如接种量超过1 mL,则用双料LST肉汤),36 ℃±1 ℃培养24 h±2 h,观察倒管内是否有气泡产生,24 h±2 h产气者进行复发酵试验,如未产气则继续培养至48 h±2 h,产气者进行复发酵试验。未产气者为大肠菌群阴性。

大肠杆菌在月桂基硫酸盐胰蛋白胨肉汤(LST)上典型特征
6.3 复发酵试验
用接种环从产气的LST肉汤管中分别取培养物1环, 移种于煌绿乳糖胆盐肉汤 (BGLB) 管中, 36 ℃±1 ℃培养48 h±2 h,观察产气情况。产气者,计为大肠菌群阳性管。
6.4 大肠菌群最可能数(MPN)的报告
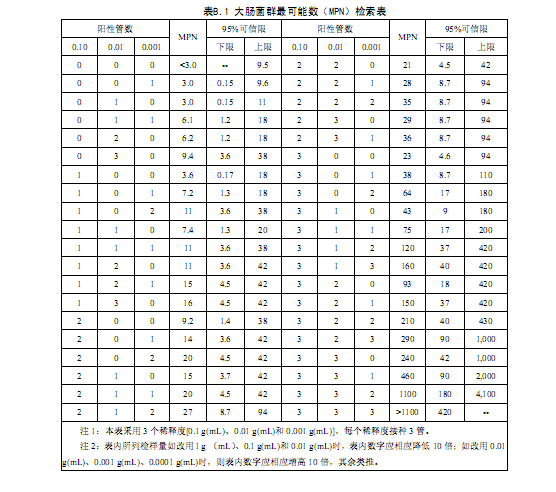
按6.3确证的大肠菌群LST阳性管数,检索MPN表(见附录B),报告每g(mL)样品中大肠菌群的MPN值。
本标准规定了食品中大肠菌群(Coliforms)计数的方法。
本标准适用于食品中大肠菌群的计数。
2 术语和定义
2.1 大肠菌群coliforms
在一定培养条件下能发酵乳糖、产酸产气的需氧和兼性厌氧革兰氏阴性无芽胞杆菌。
2.2 最可能数most probable number,MPN 基于泊松分布的一种间接计数方法。
3 设备和材料
除微生物实验室常规灭菌及培养设备外,其他设备和材料如下:
3.1 恒温培养箱:36 ℃±1 ℃。
3.2 冰箱:2 ℃~5 ℃。
3.3 恒温水浴箱:46 ℃±1 ℃。
3.4 天平:感量 0.1 g。
3.5 均质器。
3.6 振荡器。
3.7 无菌吸管:1 mL(具 0.01 mL 刻度)、10 mL(具 0.1 mL 刻度)或微量移液器及吸头。
3.8 无菌锥形瓶:容量 500 mL。
3.9 无菌培养皿:直径 90 mm。
3.10 pH计或 pH比色管或精密 pH试纸。
3.11 菌落计数器。
4 培养基和试剂
4.1 月桂基硫酸盐胰蛋白胨(Lauryl Sulfate Tryptose,LST)肉汤
4.2 煌绿乳糖胆盐(Brilliant Green Lactose Bile,BGLB)肉汤
4.3 结晶紫中性红胆盐琼脂(Violet Red Bile Agar,VRBA)
4.4 磷酸盐缓冲液
4.5 无菌生理盐水
4.6 无菌 1 mol/L NaOH
4.7 无菌 1 mol/L HCl
大肠菌群MPN计数法
5 检验程序
大肠菌群MPN计数的检验程序见图1。

6 操作步骤
6.1 样品的稀释
6.1.1 固体和半固体样品: 称取 25 g 样品,放入盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌均质杯内, 8000 r/min~10000 r/min 均质 1 min~2 min,或放入盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌均质袋中,用拍击式均质器拍打 1 min~2 min,制成 1:10 的样品匀液。
6.1.2 液体样品:以无菌吸管吸取 25 mL 样品置盛有 225 mL 磷酸盐缓冲液或生理盐水的无菌锥形瓶(瓶内预置适当数量的无菌玻璃珠)中,充分混匀,制成 1:10 的样品匀液。
6.1.3 样品匀液的 pH值应在 6.5~7.5 之间,必要时分别用 1 mol/L NaOH或 1 mol/L HCl 调节。
6.1.4 用 1 mL 无菌吸管或微量移液器吸取 1:10 样品匀液1 mL,沿管壁缓缓注入 9 mL 磷酸盐缓冲液或生理盐水的无菌试管中(注意吸管或吸头尖端不要触及稀释液面),振摇试管或换用 1 支1 mL 无菌吸管反复吹打,使其混合均匀,制成 1:100 的样品匀液。
6.1.5 根据对样品污染状况的估计,按上述操作,依次制成十倍递增系列稀释样品匀液。每递增稀释1 次,换用1支 1 mL 无菌吸管或吸头。从制备样品匀液至样品接种完毕,全过程不得超过 15 min。
6.2 初发酵试验
每个样品,选择3个适宜的连续稀释度的样品匀液(液体样品可以选择原液),每个稀释度接种3管月桂基硫酸盐胰蛋白胨(LST)肉汤,每管接种1mL(如接种量超过1 mL,则用双料LST肉汤),36 ℃±1 ℃培养24 h±2 h,观察倒管内是否有气泡产生,24 h±2 h产气者进行复发酵试验,如未产气则继续培养至48 h±2 h,产气者进行复发酵试验。未产气者为大肠菌群阴性。

大肠杆菌在月桂基硫酸盐胰蛋白胨肉汤(LST)上典型特征
6.3 复发酵试验
用接种环从产气的LST肉汤管中分别取培养物1环, 移种于煌绿乳糖胆盐肉汤 (BGLB) 管中, 36 ℃±1 ℃培养48 h±2 h,观察产气情况。产气者,计为大肠菌群阳性管。
6.4 大肠菌群最可能数(MPN)的报告
按6.3确证的大肠菌群LST阳性管数,检索MPN表(见附录B),报告每g(mL)样品中大肠菌群的MPN值。